El átomo es un constituyente de la materia ordinaria, con propiedades químicas bien definidas, formado a su vez por constituyentes más elementales sin propiedades químicas bien definidas. Cada elemento químico está formado por átomos del mismo tipo (con la misma estructura electrónica básica), y que no es posible dividir mediante procesos químicos.
Actualmente se conoce que el átomo está compuesto por un núcleo atómico, en el que se concentra casi toda su masa, rodeado de una nube de electrones. Esto fue descubierto a principios del siglo XX, ya que durante el siglo XIX se había pensado que los átomos eran indivisibles, de ahí su nombre a-tómo- 'sin división'. Poco después se descubrió que también el núcleo está formado por partes, como los protones, con carga positiva, y neutrones, eléctricamente neutros.Los electrones, cargados negativamente, permanecen ligados a este mediante la fuerza electromagnética.
Los átomos se clasifican de acuerdo al número de protones y neutrones que contenga su núcleo. El número de protones onúmero atómico determina su elemento químico, y el número de neutrones determina su isótopo. Un átomo con el mismo número de protones que de electrones es eléctricamente neutro. Si por el contrario posee un exceso de protones o de electrones, su carga neta es positiva o negativa, y se denomina ion.

Partículas subatómicas
A pesar de que átomo significa ‘indivisible’, en realidad está formado por varias partículas subatómicas. El átomo contiene protones, neutrones y electrones, con la excepción del hidrógeno-1, que no contiene neutrones, y del catión hidrógeno o hidrón, que no contiene electrones. Los protones y neutrones del átomo se denominannucleones, por formar parte del núcleo atómico.
El electrón es la partícula más ligera de cuantas componen el átomo, con una masa de 9,11 · 10−31 kg. Tiene una carga eléctrica negativa, cuya magnitud se define como la carga eléctrica elemental, y se ignora si posee subestructura, por lo que se lo considera una partícula elemental. Los protones tienen una masa de 1,67 · 10−27kg, 1836 veces la del electrón, y una carga positiva opuesta a la de este. Los neutrones tienen un masa de 1,69 · 10−27 kg, 1839 veces la del electrón, y no poseen carga eléctrica. Las masas de ambos nucleones son ligeramente inferiores dentro del núcleo, debido a la energía potencial del mismo; y sus tamaños son similares, con un radio del orden de 8 · 10-16 m o 0,8 femtómetros (fm).
El protón y el neutrón no son partículas elementales, sino que constituyen un estado ligado de quarks u y d, partículas fundamentales recogidas en el modelo estándar de la física de partículas, con cargas eléctricas iguales a +2/3 y −1/3 respectivamente, respecto de la carga elemental. Un protón contiene dos quarks u y un quark d, mientras que el neutrón contiene dos d y un u, en consonancia con la carga de ambos. Los quarks se mantienen unidos mediante la fuerza nuclear fuerte, mediada porgluones —del mismo modo que la fuerza electromagnética está mediada por fotones—. Además de estas, existen otras partículas subatómicas en el modelo estándar: más tipos de quarks, leptones cargados (similares al electrón), etc.
El núcleo atómico
Los protones y neutrones de un átomo se encuentran ligados en el núcleo atómico, la parte central del mismo. El volumen del núcleo es aproximadamente proporcional al número total de nucleones, el número másico A, lo cual es mucho menor que el tamaño del átomo, cuyo radio es del orden de 105 fm o 1 ångström (Å). Los nucleones se mantienen unidos mediante la fuerza nuclear, que es mucho más intensa que la fuerza electromagnética a distancias cortas, lo cual permite vencer la repulsión eléctrica entre los protones.
Los átomos de un mismo elemento tienen el mismo número de protones, que se denomina número atómico y se representa por Z. Los átomos de un elemento dado pueden tener distinto número de neutrones: se dice entonces que son isótopos. Ambos números conjuntamente determinan el núclido.
El núcleo atómico puede verse alterado por procesos muy energéticos en comparación con las reacciones químicas. Los núcleos inestables sufren desintegracionesque pueden cambiar su número de protones y neutrones emitiendo radiación. Un núcleo pesado puede fisionarse en otros más ligeros en una reacción nuclear oespontáneamente. Mediante una cantidad suficiente de energía, dos o más núcleos pueden fusionarse en otro más pesado.
En átomos con número atómico bajo, los núcleos con una cantidad distinta de protones y neutrones tienden a desintegrarse en núcleos con proporciones más parejas, más estables. Sin embargo, para valores mayores del número atómico, la repulsión mutua de los protones requiere una proporción mayor de neutrones para estabilizar el núcleo.
Propiedades atómicas
Masa
La mayor parte de la masa del átomo viene de los nucleones, los protones y neutrones del núcleo. También contribuyen en una pequeña parte la masa de los electrones, y la energía de ligadura de los nucleones, en virtud de la equivalencia entre masa y energía. La unidad de masa que se utiliza habitualmente para expresarla es la unidad de masa atómica (u). Esta se define como la doceava parte de la masa de un átomo neutro de carbono-12 libre, cuyo núcleo contiene 6 protones y 6 neutrones, y equivale a 1,66 · 10-27 kg aproximadamente. En comparación el protón y el neutrón libres tienen una masa de 1,007 y 1,009 u. La masa de un átomo es entonces aproximadamente igual al número de nucleones en su núcleo —el número másico— multiplicado por la unidad de masa atómica. El átomo estable más pesado es elplomo-208, con una masa de 207,98 u.8
En química se utiliza también el mol como unidad de masa. Un mol de átomos de cualquier elemento equivale siempre al mismo número de estos (6,022 · 1023), lo cual implica que un mol de átomos de un elemento con masa atómica de 1 u pesa aproximadamente 1 gramo. En general, un mol de átomos de un cierto elemento pesa de forma aproximada tantos gramos como la masa atómica de dicho elemento.
Niveles de energía
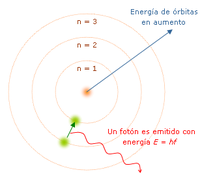
Un electrón ligado en el átomo posee una energía potencial inversamente proporcional a su distancia al núcleo y de signo negativo, lo que quiere decir que esta aumenta con la distancia. La magnitud de esta energía es la cantidad necesaria para desligarlo, y la unidad usada habitualmente para expresarla es el electrónvoltio (eV). En el modelo mecanocuántico solo hay un conjunto discreto de estados o niveles en los que un electrón ligado puede encontrarse —es decir, enumerables—, cada uno con un cierto valor de la energía. El nivel con el valor más bajo se denomina el estado fundamental, mientras que el resto se denominan estados excitados.
Cuando un electrón efectúa una transición entre dos estados distintos, absorbe o emite un fotón, cuya energía es precisamente la diferencia entre los dos niveles. La energía de un fotón es proporcional a su frecuencia, así que cada transición se corresponde con una banda estrecha del espectro electromagnético denominada línea espectral.
Cada elemento químico posee un espectro de líneas característico. Estas se detectan como líneas de emisión en la radiación de los átomos del mismo. Por el contrario, si se hace pasar radiación con un espectro de frecuencias continuo a través de estos, los fotones con la energía adecuada son absorbidos. Cuando los electrones excitados decaen más tarde, emiten en direcciones aleatorias, por lo que las frecuencias características se observan como líneas de absorción oscuras. Las medidas espectroscópicas de la intensidad y anchura de estas líneas permite determinar la composición de una sustancia.
Algunas líneas espectrales se presentan muy juntas entre sí, tanto que llegaron a confundirse con una sola históricamente, hasta que fue descubierta su subestructura o estructura fina. La causa de este fenómeno se encuentra en las diversas correcciones a considerar en la interacción entre los electrones y el núcleo. Teniendo en cuenta tan solo la fuerza electrostática, ocurre que algunas de las configuraciones electrónicas pueden tener la misma energía aun siendo distintas. El resto de pequeños efectos y fuerzas en el sistema electrón-núcleo rompe esta redundancia o degeneración, dando lugar a la estructura fina. Estos incluyen las correcciones relativistas al movimiento de electrón, la interacción de sumomento magnético con el campo eléctrico y con el núcleo, etc.
Además, en presencia de un campo externo los niveles de energía se ven modificados por la interacción del electrón con este, en general produciendo o aumentando la división entre los niveles de energía. Este fenómeno se conoce como efecto Stark en el caso de un campo eléctrico, y efecto Zeeman en el caso de un campo magnético.
Las transiciones de un electrón a un nivel superior ocurren en presencia de radiación electromagnética externa, que provoca la absorción del fotón necesario. Si la frecuencia de dicha radiación es muy alta, el fotón es muy energético y el electrón puede liberarse, en el llamado efecto fotoeléctrico.
Las transiciones a un nivel inferior pueden ocurrir de manera espontánea, emitiendo la energía mediante un fotón saliente; o de manera estimulada, de nuevo en presencia de radiación. En este caso, un fotón «entrante» apropiado provoca que el electrón decaiga a un nivel con una diferencia de energía igual a la del fotón entrante. De este modo, se emite un fotón saliente cuya onda asociada está sincronizada con la del primero, y en la misma dirección. Este fenómeno es la base del láser.
Interacciones eléctricas entre protones y electrones
Antes del experimento de Rutherford la comunidad científica aceptaba el modelo atómico de Thomson, situación que varió después de la experiencia de Ernest Rutherford. Los modelos posteriores se basan en una estructura de los átomos con una masa central cargada positivamente rodeada de una nube de carga negativa.
Este tipo de estructura del átomo llevó a Rutherford a proponer su modelo en que los electrones se moverían alrededor del núcleo en órbitas. Este modelo tiene una dificultad proveniente del hecho de que una partícula cargada acelerada, como sería necesario para mantenerse en órbita, radiaría radiación electromagnética, perdiendo energía. Las leyes de Newton, junto con las ecuaciones de Maxwell del electromagnetismo aplicadas al átomo de Rutherford llevan a que en un tiempo del orden de 10−10s, toda la energía del átomo se habría radiado, con la consiguiente caída de los electrones sobre el núcleo.
Evolución del modelo atómico
La concepción del átomo que se ha tenido a lo largo de la historia ha variado de acuerdo a los descubrimientos realizados en el campo de la física y la química. A continuación se hará una exposición de los modelos atómicos propuestos por los científicos de diferentes épocas. Algunos de ellos son completamente obsoletos para explicar los fenómenos observados actualmente, pero se incluyen a manera de reseña histórica.
Modelo de Dalton
Fue el primer modelo atómico con bases científicas, fue formulado en 1803 por John Dalton, quien imaginaba a los átomos como diminutas esferas.19 Este primer modelo atómico postulaba:
- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes.
- Los átomos permanecen sin división, aun cuando se combinen en las reacciones químicas.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
- Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.
Sin embargo desapareció ante el modelo de Thomson ya que no explica los rayos catódicos, la radioactividad ni la presencia de los electrones (e-) o protones(p+).
Modelo de Thomson
Luego del descubrimiento del electrón en 1897 por Joseph John Thomson, se determinó que la materia se componía de dos partes, una negativa y una positiva. La parte negativa estaba constituida por electrones, los cuales se encontraban según este modelo inmersos en una masa de carga positiva a manera de pasas en un pastel (de la analogía del inglés plum-pudding model) o uvas en gelatina. Posteriormente Jean Perrin propuso un modelo modificado a partir del de Thomson donde las «pasas» (electrones) se situaban en la parte exterior del «pastel» (la carga positiva).
Para explicar la formación de iones, positivos y negativos, y la presencia de los electrones dentro de la estructura atómica, Thomson ideó un átomo parecido a un pastel de frutas. Una nube positiva que contenía las pequeñas partículas negativas (los electrones) suspendidos en ella. El número de cargas negativas era el adecuado para neutralizar la carga positiva. En el caso de que el átomo perdiera un electrón, la estructura quedaría positiva; y si ganaba, la carga final sería negativa. De esta forma, explicaba la formación de iones; pero dejó sin explicación la existencia de las otras radiaciones.
Modelo de Rutherford
Este modelo fue desarrollado por el físico Ernest Rutherford a partir de los resultados obtenidos en lo que hoy se conoce como el experimento de Rutherford en 1911. Representa un avance sobre el modelo de Thomson, ya que mantiene que el átomo se compone de una parte positiva y una negativa, sin embargo, a diferencia del anterior, postula que la parte positiva se concentra en un núcleo, el cual también contiene virtualmente toda la masa del átomo, mientras que los electrones se ubican en una corteza orbitando al núcleo en órbitas circulares o elípticas con un espacio vacío entre ellos. A pesar de ser un modelo obsoleto, es la percepción más común del átomo del público no científico.
Rutherford predijo la existencia del neutrón en el año 1920, por esa razón en el modelo anterior (Thomson), no se habla de éste.
Por desgracia, el modelo atómico de Rutherford presentaba varias incongruencias:
- Contradecía las leyes del electromagnetismo de James Clerk Maxwell, las cuales estaban muy comprobadas mediante datos experimentales. Según las leyes de Maxwell, una carga eléctrica en movimiento (en este caso el electrón) debería emitir energía constantemente en forma de radiación y llegaría un momento en que el electrón caería sobre el núcleo y la materia se destruiría. Todo ocurriría muy brevemente.
- No explicaba los espectros atómicos.
Modelo de Bohr
Este modelo es estrictamente un modelo del átomo de hidrógeno tomando como punto de partida el modelo de Rutherford, Niels Bohr trata de incorporar los fenómenos de absorción y emisión de los gases, así como la nueva teoría de la cuantización de la energía desarrollada por Max Planck y el fenómeno del efecto fotoeléctrico observado por Albert Einstein.
«El átomo es un pequeño sistema solar con un núcleo en el centro y electrones moviéndose alrededor del núcleo en órbitas bien definidas». Las órbitas están cuantizadas (los e- pueden estar solo en ciertas órbitas)
- Cada órbita tiene una energía asociada. La más externa es la de mayor energía.
- Los electrones no radian energía (luz) mientras permanezcan en órbitas estables.
- Los electrones pueden saltar de una a otra órbita. Si lo hace desde una de menor energía a una de mayor energía absorbe un cuanto de energía (una cantidad) igual a la diferencia de energía asociada a cada órbita. Si pasa de una de mayor a una de menor, pierde energía en forma de radiación (luz).
El mayor éxito de Bohr fue dar la explicación al espectro de emisión del hidrógeno. Pero solo la luz de este elemento. Proporciona una base para el carácter cuántico de la luz, el fotón es emitido cuando un electrón cae de una órbita a otra, siendo un pulso de energía radiada.
Bohr no pudo explicar la existencia de órbitas estables y para la condición de cuantización.
Bohr encontró que el momento angular del electrón es h/2π por un método que no puede justificar.
Modelo de Schrödinger
Después de que Louis-Victor de Broglie propuso la naturaleza ondulatoria de la materia en 1924, la cual fue generalizada porErwin Schrödinger en 1926, se actualizó nuevamente el modelo del átomo.
En el modelo de Schrödinger se abandona la concepción de los electrones como esferas diminutas con carga que giran en torno al núcleo, que es una extrapolación de la experiencia a nivel macroscópico hacia las diminutas dimensiones del átomo. En vez de esto, Schrödinger describe a los electrones por medio de una función de onda, el cuadrado de la cual representa laprobabilidad de presencia en una región delimitada del espacio. Esta zona de probabilidad se conoce como orbital. La gráfica siguiente muestra los orbitales para los primeros niveles de energía disponibles en el átomo de hidrógeno.
Modelo de Dirac
El modelo de Dirac usa supuestos muy similares al modelo de Schrödinger aunque su punto de partida es una ecuación relativista para la función de onda, la ecuación de Dirac. El modelo de Dirac permite incorporar de manera más natural el espín del electrón. Predice niveles energéticos similares al modelo de Schrödinger proporcionando las correcciones relativistas adecuadas.
Modelos posteriores
Tras el establecimiento de la ecuación de Dirac, la teoría cuántica evolucionó hasta convertirse propiamente en una teoría cuántica de campos. Los modelos surgidos a partir de los años 1960 y 1970 permitieron construir teorías de las interacciones de los nucleones. La vieja teoría atómica quedó confinada a la explicación de la estructura electrónica que sigue siendo explicada de manera adecuada mediante el modelo de Dirac complementado con correcciones surgidas de la electrodinámica cuántica. Debido a la complicación de las interacciones fuertes sólo existen modelos aproximados de la estructura del núcleo atómico. Entre los modelos que tratan de dar cuenta de la estructura del núcleo atómico están el modelo de la gota líquida y el modelo de capas.
Posteriormente, a partir de los años 1960 y 1970, aparecieron evidencias experimentales y modelos teóricos que sugerían que los propios nucleones (neutrones, protones) y mesones (piones) que constituyen el núcleo atómico estarían formados por constituyentes fermiónicos más elementales denominados quarks. La interacción fuerte entre quarks entraña problemas matemáticos complicados, algunos aún no resueltos de manera exacta. En cualquier caso lo que se conoce hoy en día deja claro que la estructura del núcleo atómico y de las propias partículas que forman el núcleo son mucho más complicadas que la estructura electrónica de los átomos. Dado que las propiedades químicas dependen exclusivamente de las propiedades de la estructura electrónica, se considera que las teorías actuales explican satisfactoriamente las propiedades químicas de la materia, cuyo estudio fue el origen del estudio de la estructura atómica.









No hay comentarios.:
Publicar un comentario